 16 Сентября 2014
16 Сентября 2014
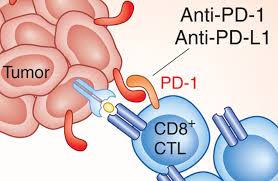
PD-1 ингибитор получил ускоренное одобрение Управления по контролю качества пищевых продуктов и медикаментов (Food and Drug Administration, FDA) для лечения метастатической меланомы.
Данные FDA от 4 сентября 2014 г.
Управление по контролю качества пищевых продуктов и медикаментов США досрочно одобрил к применению препарат пембролизумаб, ингибитор PD-1 (рецептор “запрограммированной смерти” клетки), для лечения пациентов с нерезектабельной или метастатической меланомой, не поддающейся терапии другими препаратами. Пембролизумаб (Keytruda; Merck) используется после предшествующей терапии ипилимумабом. В соответствии с позицией FDA, больным меланомой с наличием мутацией BRAF V600 препарат должен назначаться после проведения терапии ипилимумабом в сочетании с BRAF-ингибитором.
Одобренная доза соответствует 2 мг/кг каждые 3 недели для пациентов с нерезектабельной и метастатической меланомой после неудачи первичной терапии. Использование препарата в этом режиме основано на показателях величины и продолжительности опухолевого ответа. Улучшение показателей выживаемости и симптомов заболевания на фоне применения препарата пока не доказано. В настоящее время продолжается ряд исследований, в которых будет дополнительно изучены показатели клинического ответа. Ожидается, что ускоренное одобрение пембролизумаба также позволит оперативно получить эти данные.
В пилотном исследовании участвовало 173 пациента с метастатической меланомой, у которых было зарегистрировано прогрессирование заболевания после проведенного лечения. Все пациенты получали пембролизумаб в дозе 2 мг/кг либо в более высокой дозе 10 мг/кг. У почти 24% пациентов, получавших пембролизумаб в рекомендуемой дозе 2 мг/кг, было достигнуто уменьшение размеров опухоли. Этот эффект держался на протяжении не менее 1,4-8,5 мес., а у большинства пациентов продолжал сохраняться и дольше.
У 6% из 89 пациентов, получавших препарат в дозе 2 мг/кг, и у 9% из 411 пациентов, получавших любую дозу препарата, он был отменен в связи с развитием нежелательных явлений. Серьезные нежелательные явления (СНЯ) были зарегистрированы у 36% пациентов, получавших терапию пембролизумаб. Наиболее частыми СНЯ, зарегистрированными у 2% пациентов, стали почечная недостаточность, пневмония, диспноэ и воспаление соединительной ткани. Среди нежелательных явлений, зарегистрированных у 20% из 411 пациентов, были отмечены: слабость (47%), кашель (30%), тошнота (30%), сыпь (29%), снижение аппетита (26%), запоры (21%), артралгии (20%) и диарея (20%).
FDA выражает опасения, что пембролизумаб может вызывать тяжелые побочные иммунные реакции, хотя среди 411 больных метастатической меланомой тяжелые подобные иммунные реакции с вовлечением здоровых органов (легкие, толстый кишечник, железы внутренней секреции, печень) были нечастыми. Это уже 6-й препарат, одобренный для лечения меланомы с 2011 г., включая ипилимумаб (2011 г.), пегинтерферон альфа-2b (2011 г.), вемурафениб (2011 г.), дабрафениб (2013 г.) и траметиниб (2013 г.).




